Utilisation de l’eau
Nous utilisons l’eau pour de multiples applications en dehors de la boisson, pourtant la chimie de l’eau nous est globalement inconnue. Pourquoi des surfaces immergées s’encrassent-elles ? Pourquoi avons-nous besoin de nous savonner sous notre douche ?
Voilà pourtant de nombreux domaines ou nous utilisons cette chimie si particulière qu’elle en est unique :
- Nettoyage et Lavage
- Matière première
- Nous produisons de la vapeur pour créer une force ou transporter de l’énergie
- Nous nous en servons pour refroidir des services qui nous sont utiles comme la climatisation ou des radiateurs de voitures.
- Et nous nous en servons dans différents procédés industriels.

Si l’eau possède la faculté de s’adapter à de nombreux usage, il y a des limites à son utilisation.
C’est ainsi que son utilisation génère des problèmes de tartre, de corrosion ou de dépôts liés à de l’activité bactérienne. Cela se traduit par un encrassement des équipements comme vous pouvez le voir par exemple ci-joint dans un lave-vaiselle.
Le pouvoir magique de l’eau
Pourquoi l’eau est-elle liquide ?
Nous croyons tous que l’eau se présente sous une forme simple, cette molécule ci-contre|
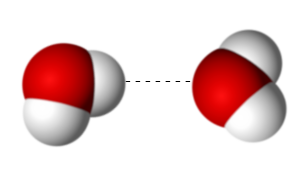
Deux petits atomes d’hydrogène reliés à l’oxygène au centre par une liaison forte, dite liaison covalente. Pourtant, l’atome d’hydrogène est si petit, qu’il ne contient qu’une particule au centre, un proton. L’oxygène à ses côtés a un noyau qui en contient 16 ! Un monstre. Si le noyau de l’atome d’hydrogène était une boule de 1m de diamètre, l’atome d’oxygène formerait une boule de 2 à 3m à la distance de …110 kms Imaginez un instant que ce petit bout de rien du tout, mon noyau d’hydrogène, un proton, se retrouve influencé à 120km, de l’autre côté, par un autre atome d’oxygène ? Tel un petit chien qui se promènerait entre ses deux maîtres, ce proton va donc se lier aussi avec cet autre oxygène. Ce phénomène, bien connu des chimistes et des physiciens s’appelle la LIAISON HYDROGENE. |
|
Crédits images Wikipedia
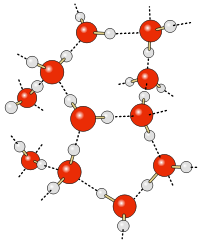
La forme tétraédrique de l’eau
L’ensemble des molécules d’eau qui vont être présentes, dans un verre d’eau par exemple, vont donc se relier en créant des ponts entre elles. Ces ponts sont stables et confèrent à l’eau une structure organisée mais suffisamment plastique (déformable) pour s’adapter parfaitement à tout contenant ou type de situation.
 |
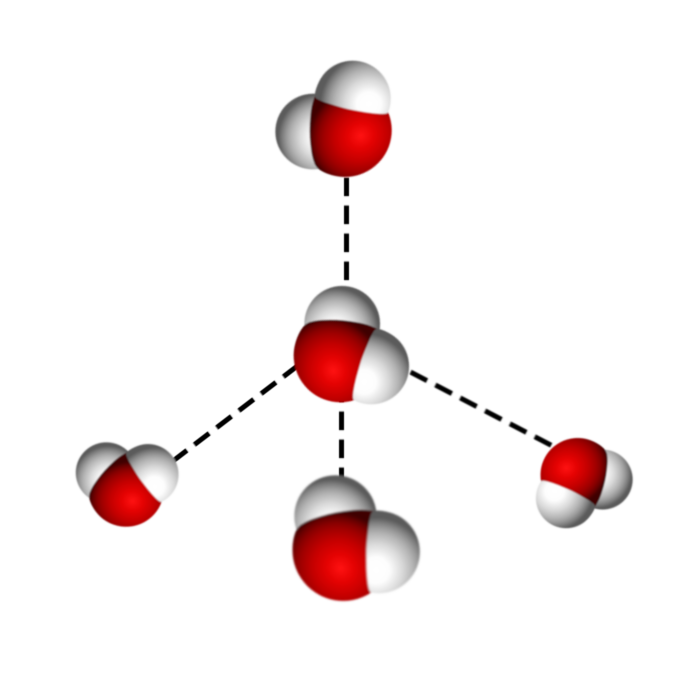 |
Ces liaisons vont créer une structure complexe dont la forme de base est un tétraèdre reliant un atome d’oxygène au centre et quatre atomes d’oxygène aux quatre sommets par des liaisons hydrogènes.
Ces structures réagissent avec la température.
C’est cette propriété particulière de l’eau qui explique le phénomène visible dans la vidéo prise dans la station spatiale internationale.
Sans cette structure et sans les liaisons hydrogène, en apesanteur l’eau se fragmenterait immédiatement en molécules, donc sous forme de gaz.
Les conséquences de ce phénomène sont exposées page suivante.
Pourquoi l’eau ne mouille pas (ou pas si bien que ça !)
Si la structure complexe de l’eau permet une grande adaptabilité aux contenants dans laquelle elle se trouvera, en revanche sa grande stabilité a pour conséquence assez paradoxale de ne pas rendre la molécule d’eau disponible pour mouiller (on dit hydrater) une surface ou une poussière, un débris.
|
Lorsque l’eau se trouve polluée par des débris, des bactéries, de la salissure microscopique, ou plus simplement si l’eau est trop dure et que le tartre tend à se déposer alors la structure tétraédrique de l’eau aura tendance à accélérer l’apparition de dépôts. |
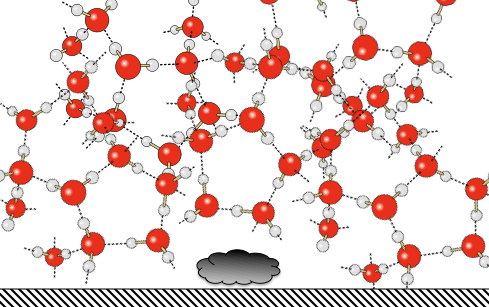 |
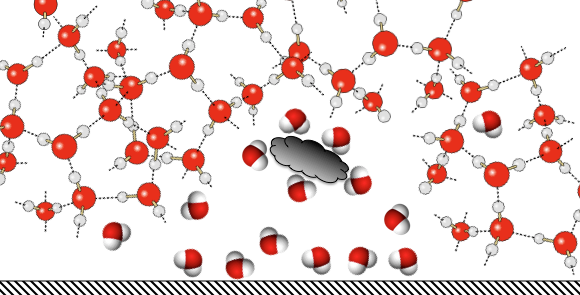 |
Afin de lutter contre ce phénomène il faut rendre la molécule d’eau disponible et rendre les surfaces plus à même de capter des molécules d’eau extraites des structures complexes. |
L’hydratation des éléments dans l’eau
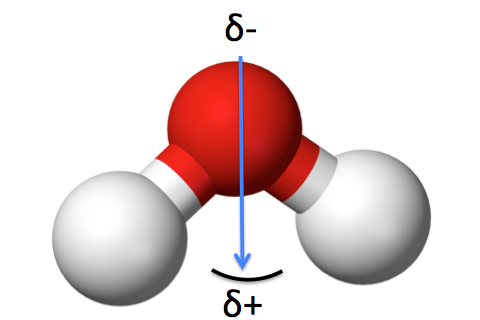 Moment dipolaire de la molécule d’eau |
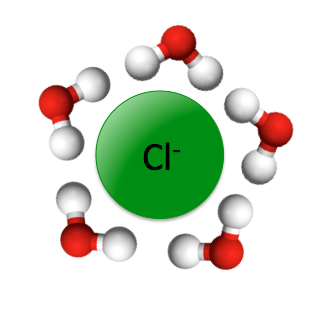 Solvatation du chlorure dans l’eau |
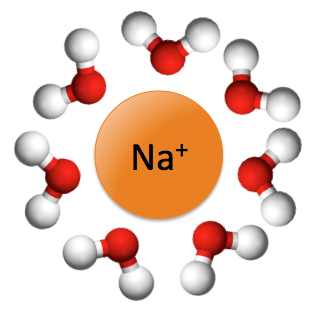 Solvatation du sodium par l’eau |
Voir la suite et comment un circuit d’eau, une machine s’encrassent.